双特异性抗体(BsAb)又称双功能抗体,可同时识别两种不同的抗原和表位,并且阻断两种不同的信号通路以发挥作用。
BsAb与普通抗体相比增加了一个特异性抗原结合位点,
主要表现在以下几个方面:
(1)能够介导免疫细胞对肿瘤的杀伤
(2)双靶点信号阻断,发挥独特的或重叠的功能,有效防止耐药
(3)具备更强特异性、靶向性和降低脱靶毒性
(4)有效降低治疗成本
目前双特异性抗体的制备方法主要有化学偶联、双杂交瘤细胞法、重组基因制备法等。
1 化学偶联法
该方法最早出现于上世纪80年代,其原理是通过化学偶联剂(如邻苯二马来酰亚胺、N-琥珀酰-3-(2-吡啶二硫基)丙酸盐、二硫代酰基苯甲酸等)将两个完整IgG或两个F(ab)2抗体片段偶联成一种BsAb,
这种方法快速简便,但是容易破坏抗原结合部位从而影响抗体活性,同时交联剂本身的安全性和致癌性也不确定。
图1所示为使用化学偶联法生产的双特异性抗体快速检测食物中的病原菌。
用红细胞与弗氏佐剂完全融合(150 mg)混合物注射入雌性家兔,初级免疫21天后注射100 mg的红细胞与弗氏佐剂完全融合(150 mg)混合物进行二次免疫,第28天后从血浆中获得血清,利用交联红细胞吸附柱获得特异性红细胞抗体。将李斯特菌细胞表面蛋白与弗氏佐剂乳化(100 mg)注入雌性家兔进行免疫,21天后增加50 mg抗体进行主要免疫,5天后采集血清,将血清纯化并用李斯特菌亲和柱获得anti-Listeria抗体。
通过增加β-巯基乙磺酸钠盐和β-巯基乙醇的浓度(0-60 mM),从而有效还原单抗和多抗之间的二硫键,单源抗体通过添加等体积的2倍浓度的蒸馏水溶解的β-巯基乙磺酸钠盐(60 mM),将此溶液与混合了1 mg鼠源单克隆的anti-L、产单核细胞LZH1IgG1和鼠源单克隆IgG2a上调的对抗人红细胞膜表面蛋白(protein4.2(2G-12))的PBS溶液中,37℃孵育25 min。随后单价的抗体暴露在氧化条件下,再通过针对3种缓冲液的PBS进行透析,pH7.4,4℃24 h。用同样的方法使用人类红细胞或L-单核细胞表面抗原纯化,单克隆和多克隆的双特异性抗体通过含有亲本抗体的亲和柱进行纯化,从而获得含有两种抗体的双特异性抗体。
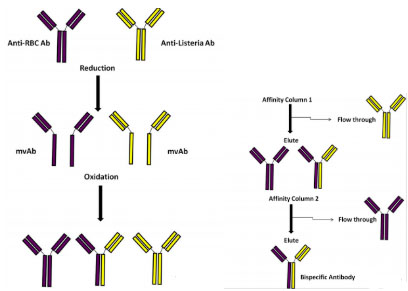
图1:抗人红细胞表面抗原和李斯特菌表面抗原的双特异性抗体的制备过程
图2所示为化学偶联法合成的双特异性抗体。
首先获得抗肿瘤(α-T)和抗半抗原(α-H)的Fab片段的抗体。先将抗肿瘤Fab’与双功能的N, N' -o-苯乙烯-二马来酰亚胺(PDM)连接,随后将抗半抗原的Fab’片段加入,形成稳定的Fab’×Fab’的双特异性抗体。
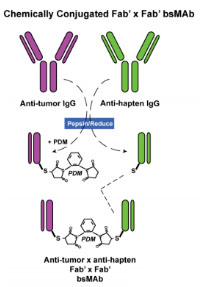
图2:化学法合成双特异性抗体
2 双杂交瘤融合法
通过细胞融合的方法将2株不同的杂交瘤细胞融合成双杂交瘤细胞株,然后通过常规的杂交瘤筛选法克隆靶细胞。
由于双杂交瘤的遗传背景来源于亲代的两种杂交瘤细胞,它必然要产生2种重链和2种轻链分子,而这些轻重链的随机组合配对方式才能产生所需的BsAb。
利用双杂交瘤方法制备BsAb随机性较大,效率低,但是BsAb生物活性较好,抗体结构比较稳定。利用Konck-in-hole技术可以有效解决异源抗体重链正确配对的难题。
制备方法是将一个抗体的重链CH3区366位体积较小的苏氨酸突变为体积较大的酪氨酸,形成突出的“杵”型结构;
将另一个抗体重链CH3区407位较大的络氨酸残基突变成较小的苏氨酸,形成凹陷的“臼”型结构;
利用“杵臼”结构的空间位阻效应实现两种不同抗体重链间的正确装配。
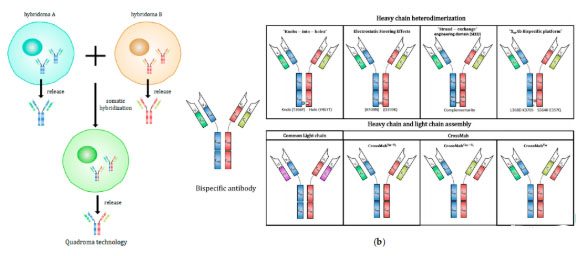
图3:细胞融合法构建双特异性抗体
每个杂交瘤细胞预先与特异性抗原刺激进而产生特异性的单克隆抗体。将此两个表达特异性抗体的细胞融合在一起,获得杂交瘤细胞且同时具有两个亲本的重链和轻链,此融合的杂交瘤细胞能够同时表达双亲的和两者混合的免疫原性。
此双细胞融合技术是产生双特异性抗体的基础,但由此产生的双特异性抗体产量低且具有较强的产物异质性。随机产生的两种重链和轻链可以产生10种不同的分子结构且只有一种具有双特异性抗体的功能。通过双杂交瘤产生有功能双特异性抗体的比例是不可预知的,工作量较大,从杂交瘤细胞产生的所有种类的双特异性抗体筛选出需要的双抗是个十分困难的工作。
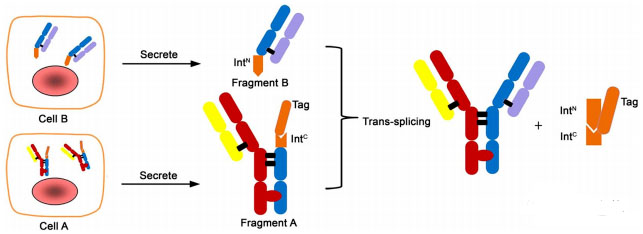
图4:双特异性抗体构建示意图
图4所示,此双特异性抗体由2个Fab结构域和一个具有生物学功能的二聚体的Fc结构域。
抗体在自然状态下的成熟过程中,重链先通过二聚体作用,随后轻链与之配对。由于抗体分子装配的临界状态,维持这个过程是十分合适的,在这个过程中重链/重链和重链/轻链的组合是自然发生的。因此,我们选择合成的两个抗体臂,其中一个臂具有二聚体的Fc结构域,另一个则没有。并将两个抗体臂分别在哺乳动物细胞中表达,以此来消除重/轻链的错配。选择对功能影响较小的绞链区连接两个臂,连接方法可以通过化学法或酶方法完成,在此方法中,选择了一个裂解肽,能够通过“PTS”催化作用将两个臂连接。两个mAbs携带必要的内源肽组分并通过“PTS”功能连接,如图4所示。我们把此分子结构叫做“BAPTS”(双特异性抗体通过蛋白质反式剪接),此方法解决了重/轻链错配的问题。
此“Knobs-into-Holes”或者别的Fc工程方法能够都能够用于此方法进而提高重链/轻链的错配问题。
3 重组基因
利用基因工程技术制备BsAb是目前最常用的制备方法,其制备原理为利用基因工程技术对传统抗体进行基因工程方面的改造,从而形成多种形式的双特性抗体。
主要通过两种途径实现,其一是将编码两种单抗的重/轻链基因同时转入骨髓瘤细胞系,或是将一种单抗的轻、重链基因转入可分泌另外一种单抗的杂交瘤细胞中;其二是通过构建单链抗体制备的。
图5所示为基因工程方法构建双特异性抗体。
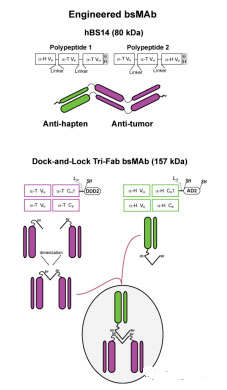
图5:基因工程方法构建双特异性抗体示意图
其分子构成主要包括hBS14(anti-CEACAM5×anti-679HSG)和几个反式-Fab(TF)片段结构,每一个都能结合一个不同的肿瘤抗原,但所有的抗原都是anti-HSG半抗原结合抗体。
其中hBs14结构由单克隆抗体获得,反式-Fab中的Dock-and-Lock结构由2个单独的克隆产生。其中一个产物为抗肿瘤蛋白质,使用二聚域(DDD2)肽序列和对接结构,半胱氨酸放在一个重要的位置成为一个设计的DDD2结构。Fab-DDD2组成一个二聚体,此二聚体结构有一个对接结构与将会与锚定结构域连接,并用2个半胱氨酸(AD2)修饰。这个结构将会一方面结合肿瘤,另一方面结合半抗原。






